Esportare Farmaci nell'Unione Economica Eurasiatica e nei Paesi CSI


Per esportare prodotti farmaceutici nell’Unione Economica Eurasiatica e nei Paesi CSI occorre tenere in considerazione che esistono diverse normative nazionali e non sempre un’autorizzazione valida in un Paese è riconosciuta anche in un altro.
La regione CSI appartiene al cosiddetto gruppo dei mercati “Pharmerging”, ossia quelli con un alto potenziale e prospettive redditizie per le case farmaceutiche, ma che potrebbero anche avere alti rischi e volatilità.
Mentre l’Unione Europea ha una normativa comune a tutti gli Stati membri con alcune differenze nazionali, nella regione della CSI non esisteva una legislazione comune fino all’entrata in vigore nel 2017 di nuovi regolamenti comuni per alcuni degli stati membri dell’Unione Economica Euroasiatica (EAEU).
A seguito della creazione nel 2014 dell’EAEU, i membri (Armenia, Bielorussia, Kazakistan, Kirghizistan e Russia) hanno dovuto allineare le proprie normative nazionali in campo farmaceutico, dall’autorizzazione alla farmacovigilanza. Anche se la regione ha un grande potenziale di sviluppo, non si sono avverate le aspettative per la creazione di un mercato farmaceutico unico che unisca gli Stati membri della EAEU e consenta loro di lavorare con un unico regolatore; le normative vengono infatti attualmente implementate in un modo leggermente diverso da quello originariamente annunciato.
Ciò significa che se un’azienda farmaceutica vuole essere presente nella regione, essa deve presentare domanda tramite procedure nazionali in ogni Paese. Inoltre, le attività successive all’autorizzazione variano da Paese a Paese. Ognuno dei 5 stati membri della EAEU ha infatti uno specifico approccio normativo, nonostante gli standard comuni EAEU siano stati parzialmente implementati a livello di legislazione nazionale. Gli standard EAEU sono stati adottati per la struttura unificata del dossier di registrazione che, sebbene sia dotata di un apposito sistema informatico, non è ancora molto diffusa. L’appartenenza del Paese all’unione doganale influisce comunque in modo significativo sulle normative nazionali e consente di effettuare registrazioni sia a livello nazionale che “centralizzate” per tutti i Paesi dell’EAEU.
Sebbene la capacità di lavorare attraverso i canali digitali esista, l’attuale sistema di registrazione centralizzato non è in grado di gestire il grande volume di domande di registrazione proveniente da tutti i Paesi membri. Inoltre, le ispezioni GMP (Good Manufacturing Practices) sono state sospese a causa della pandemia e dell’indisponibilità tecnica dei Paesi ad effettuare le ispezioni.
Per il periodo dal 2021 al 2025 è stato comunque istituito il riconoscimento reciproco dei:
Il Kazakistan è il Paese leader per la procedura di mutuo riconoscimento nella EAEU, mentre Bielorussia e Kazakistan hanno presentato un appello all’organismo di governo della EAEU per rinviare la piena transizione alle procedure EAEU mantenendo le procedure nazionali.
Era in atto una discussione sulle questioni relative alla semplificazione delle rigide procedure per il riconoscimento delle registrazioni in ambito EAEU, ma il 5 ottobre 2020 i Paesi membri hanno deciso di estendere le procedure nazionali di 2 anni, anche perché la situazione è ulteriormente complicata dall’instabile situazione politica in Bielorussia (a partire dall’agosto 2020) e dal conflitto militare tra Armenia e Azerbaigian (dal settembre 2020).
Attualmente il tempo medio per il riconoscimento da parte degli altri membri EAEU della registrazione avvenuta in un altro Paese è compreso tra i 10 e 20 mesi.
Per quanto riguarda gli altri Stati dell’area CSI non appartenenti alla EAEU, bisogna evidenziare che ogni Paese ha un proprio sistema indipendente di autorizzazione all’immissione in commercio, gestione della qualità e della sicurezza dei prodotti medici, con un gran numero di caratteristiche e sfumature nazionali. Ogni Paese, inoltre, ha la propria lingua nazionale e solo in alcuni il russo ha lo status di seconda lingua.
In alcuni Paesi per ottenere la registrazione (equivalente all’autorizzazione all’immissione in commercio) è possibile seguire un processo semplificato, a causa del numero limitato di produttori nazionali o per permettere tariffe più basse per il sistema sanitario. Ad esempio, la Georgia ha una politica di registrazione semplificata dei prodotti che hanno ricevuto l’approvazione in Paesi con requisiti normativi elevati (UE, USA, ecc.), e sono consentite importazioni parallele nel rispetto del regime di riconoscimento per i farmaci la cui qualità è stata valutata positivamente dalle autorità di regolamentazione dei Paesi sviluppati.
L’Ucraina e la Moldavia invece hanno scelto la strada dell’integrazione con l’Unione Europea e stanno gradualmente armonizzando la propria legislazione con quella europea. La normativa di questi Stati in ambito di autorizzazione alla circolazione nel mercato dei prodotti medici si basa sulle direttive europee e prevede condizioni semplificate per i produttori di Paesi con requisiti normativi elevati. Nel 2020 in Ucraina l’elenco dei Paesi per i quali è stato riconosciuto il certificato di conformità GMP è stato ridotto a EU27 + MRAs + UK ed è stata introdotta la possibilità di ispezione remota. La legislazione sulla registrazione semplificata dei medicinali è stata aggiornata, così come sono state apportate modifiche alla procedura per la registrazione semplificata e accelerata dei medicinali mediante riconoscimento.
Anche l’Uzbekistan mostra progressi significativi verso l’attuazione delle norme e dei requisiti europei per la registrazione dei farmaci e nel 2018 ha adottato un regolamento sulle procedure per il riconoscimento dei risultati della registrazione di medicinali e sostanze di Paesi con requisiti normativi elevati, svolgendo nel 2019 le prime registrazioni con procedura semplificata, a dimostrazione del buon esito della procedura di riconoscimento.
In Azerbaigian dal luglio 2020 è stata introdotta la procedura di registrazione accelerata. Inoltre, sono entrate in vigore nuove regole per lo svolgimento della farmacovigilanza, che obbligano i titolari delle autorizzazioni all’immissione in commercio a istituire e mantenere un sistema di farmacovigilanza in Azerbaigian e a nominare una persona di contatto in loco.
Altri Paesi dell’area comprendono il Tagikistan, dove la registrazione dei farmaci è più economica e il Turkmenistan - il Paese più complicato per via dell’accesso limitato alle informazioni pubbliche.
Paesi CSI sotto importanti processi di trasformazione
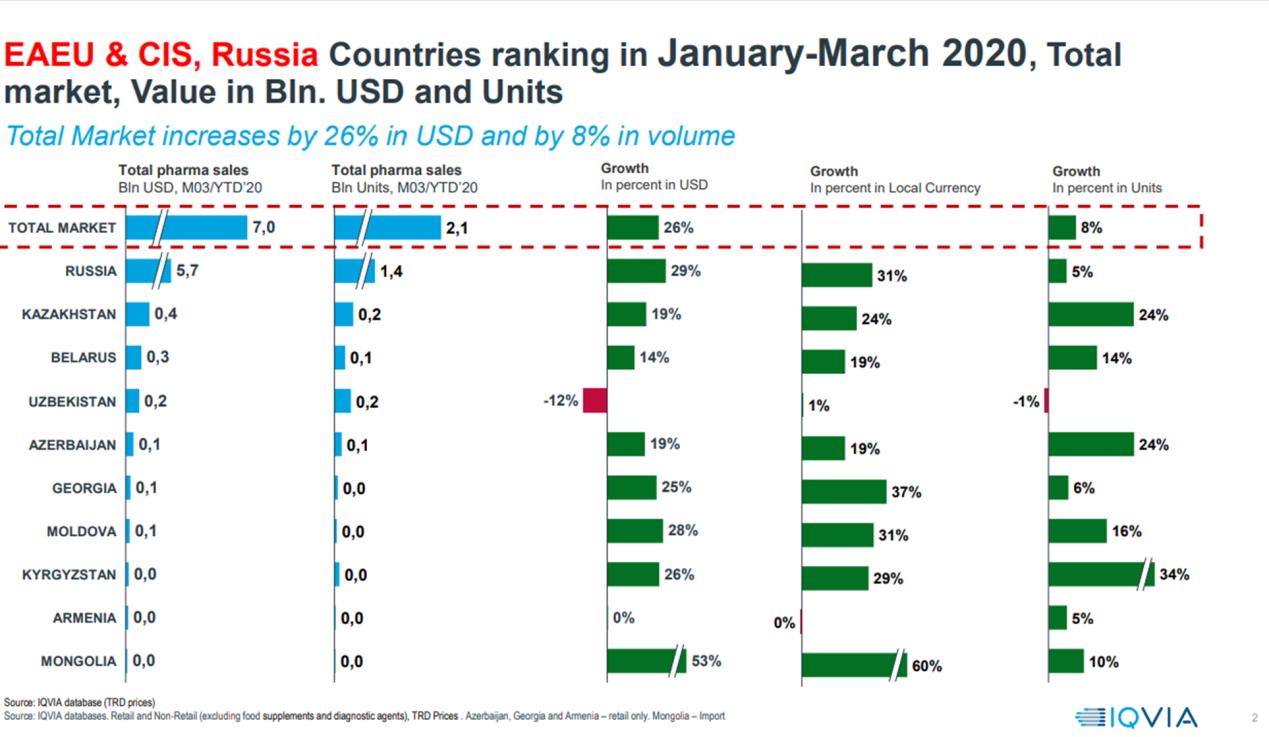
In generale, il mercato farmaceutico dei Paesi della CSI e della Russia è fortemente dinamico per via di importanti processi di trasformazione nei loro sistemi sanitari. Nel periodo dal 2017 al 2019 i mercati farmaceutici si sono sviluppati in modo abbastanza sincrono, con una crescita maggiore per i mercati di Ucraina (19%) e Uzbekistan (24%). Nel periodo gennaio-agosto 2020 sono cresciuti i mercati di Kazakistan (28%), Bielorussia (21%) e Georgia (19%). Secondo IQVIA - fornitore multinazionale di sviluppo biofarmaceutico e servizi di outsourcing commerciale - rispetto all’anno in corso, entro il 2024 il mercato del settore farmaceutico nei Paesi della CSI crescerà di circa 1,5 volte. È chiaro che la Federazione Russa ha la quota maggiore di crescita (70%), seguita dall’Ucraina (16%) e dal Kazakistan e Uzbekistan (entrambi 12%).
In conclusione, è importante considerare che i mercati farmaceutici dei Paesi CSI potrebbero essere tra quelli con una maggiore crescita nei prossimi 5 anni, ma per sfruttare questo potenziale è necessario determinare quali siano le priorità commerciali per meglio tenere conto della diversità tra Paesi sia in termini di legislazione sia di specificità nella catena di approvvigionamento.
Vuoi approfondire le opportunità che l’area CSI ed EAEU offrono alla tua impresa? Compila questo form ed entra in contatto con la nostra esperta.
Fonte: a cura di Exportiamo, di Narmin Rahimova, redazione@exportiamo.it
© RIPRODUZIONE RISERVATA